Gleichzeitig rückt die Erkenntnis in den Vordergrund, dass Demenz eine multifaktorielle Erkrankung ist, bei der neurodegenerative, inflammatorische, vaskuläre und metabolische Prozesse ineinandergreifen, was einen differenzierten Therapieansatz erfordert.
Zeit der Innovation
Moderne Arzneistoffe versuchen hier einzugreifen, indem sie zum Beispiel die Bildung von Beta-Amyloid-Plaques im Gehirn reduzieren. Zugelassene Anti-Amyloid-Antikörper verlangsamen zwar den Krankheitsverlauf, ihr klinischer Nutzen ist jedoch begrenzt und auf frühe Krankheitsstadien beschränkt. Hinzu kommen obligatorische Verlaufskontrollen aufgrund potenziell lebensbedrohlicher Nebenwirkungen (Amyloid‑assoziierte Bildgebungsanomalie; ARIA).
Vor diesem Hintergrund rücken alternative therapeutische Konzepte jenseits der Amyloid-Hypothese zunehmend in den Fokus. Dazu zählen Strategien gegen Tau-Pathologie, Neuroinflammation, synaptische Dysfunktion, mitochondriale Störungen sowie metabolische Signalwege. Auch Kombinationstherapien und sequenzielle Behandlungsmodelle werden verstärkt untersucht, um dem komplexen Verlauf der Erkrankung besser gerecht zu werden.
Aufbauend auf dem sehr lesenswerten Beitrag „Neue Wege in der Demenztherapie“ beleuchtet der vorliegende Artikel in Entwicklung befindliche Substanzen und ihre Zielstrukturen.
Tau als Therapieziel
Tau stabilisiert im gesunden Gehirn die Mikrotubuli, wird aber unter Stressbedingungen hyperphosphoryliert und verdrillt sich zu fast unauflöslichen Neurofibrillen (Tangles), die sich in den Nervenzellen ablagern und zum Zelltod führen können. Diese Tau-Aggregate sind eine der Hauptursachen der Nervenzellschädigung bei Alzheimer-Demenz und korrelieren stärker mit kognitiven Symptomen und neuronaler Degeneration als Amyloid-Plaques allein.
BIIB080 (auch bekannt als IONIS-MAPTRx) ist ein experimentelles Antisense-Oligonukleotid, das die Produktion des Tau-Proteins blockiert, indem es die entsprechende mRNA des MAPT-Gens blockiert. In einer Phase-I-Studie zeigte sich ein deutlicher Rückgang von Tau in der Cerebrospinalflüssigkeit. Erste Daten der zurzeit laufenden Phase-II-Studie CELIA bei Patient:innen mit Demenz im Frühstadium werden voraussichtlich dieses Jahr publiziert und mit Spannung erwartet. Posdinemab, ein humanisierter monoklonaler Antikörper gegen phosphoryliertes p-Tau217, der gezielt an die Mitteldomäne bindet, um dessen Ausbreitung im Gehirn zu blockieren erhielt Anfang 2025 den Fast-Track-Status der FDA. Ende 2025 wurde jedoch bekannt, dass Posdinemab den klinischen Endpunkt der Phase-II-Studie mit Alzheimer-Patient:innen im Frühstadium nicht erreichen konnte. Etalanetug (ehemals E-2814) ist ein weiterer IgG-Antikörper, der im Gegensatz zu Posdinemab mit der mikrotubuli‑bindenden Region des Tau‑Proteins interagiert. Dadurch soll die Ausbreitung pathologischer Tau‑Aggregate gebremst und „Tau-Seeds“ neutralisiert werden, die sonst von Zelle zu Zelle wandern. Eine aktuelle Phase-II-Studie prüft E‑2814 in Kombination mit Lecanemab. Erste Resultate sollen 2026 vorliegen.
Das klinische Programm von Simufilam (PTI-125), zu dem vielversprechende frühe Daten existierten, wurde im November 2024 eingestellt, nachdem Phase-III-Studien keinen klinischen Nutzen gegenüber Placebo nachweisen konnten.
Synaptische Dysfunktion und Neuroprotektion
Eine Dysfunktion der Synapsen gilt als frühzeitiges pathophysiologisches Merkmal der Alzheimer-Demenz und ist eng mit kognitiven Defiziten verbunden. Wiederherstellung und Schutz der Synapsen vor oxidativem bzw. oligomerbedingtem Stress haben das Potenzial, die Signalübertragung und damit den Krankheitsverlauf zu stabilisieren. Forscher:innen sehen zudem eine mögliche Kombination mit anderen krankheitsmodifizierenden Ansätzen, da neuroprotektive Wirkstoffe synergistisch mit anderen Therapien wirken.
CT1812 ist ein niedermolekularer, oral verfügbarer Arzneistoff, der toxische Amyloid-Oligomere davon abhält, an synaptische Rezeptoren zu binden. Sicherheit und Wirksamkeit werden gegenwärtig in einer multizentrischen, doppelblind-randomisierten Phase-II-Studie an Patient:innen mit Alzheimer-Demenz im Frühstadium geprüft. Blarcamesin (ehemals ANAVEX 2-73) ist ein Sigma-1-/M1/NMDA-Rezeptoragonist. Sigma-1 reguliert die neuronale Stressantwort und Proteinhomöostase, M1 fördert die cholinerge Signaltransmission, während der Agonismus des NMDA-Rezeptors die glutamaterge Übererregung verringern kann. Parallel zur Demenz wird Blarcamesin auch in anderen neurologischen Indikationen untersucht.
Das Pro-Drug Fosgonimeton (ATH-1017) wird im Körper zu Dihexa umgewandelt. Dieses bindet an den c-Met-Rezeptor des hepatischen Wachstumsfaktors (HGF) und verstärkt dessen Wirkung. Auf diese Weise stellt Fosgonimeton die mitochondriale Funktion wieder her und schützt Neuronen vor inflammatorischen Einflüssen. In klinischen Studien ergaben sich Hinweise, die auf eine Synapsen- und Netzwerkstabilisierung hindeuten.
Neuroinflammation
Chronische Neuroinflammation, unter anderem durch Mikroglia-Aktivierung und erhöhte Zytokine, ist ein zentrales Element der Alzheimer-Pathologie. Versuche mit klassischen Medikamenten wie NSAID und selektiven COX-2-Inhibitoren verliefen jedoch enttäuschend und zeigten keinen konsistenten Nutzen. Jüngste Forschung greift die Idee der Entzündungshemmung wieder auf, fokussiert sich aber gezielt auf Mikroglia- und Zytokin-Signalwege.
Masitinib repräsentiert dabei einen der fortgeschrittensten antiinflammatorischen Wirkstoffe zur Behandlung der Alzheimer-Demenz. Der orale Tyrosinkinase-Inhibitor hemmt die Mastzell- und Mikroglia-Aktivierung und reduziert dadurch potenziell toxische Mikroglia-Antworten. Phase-III-Studien bei leichter bis moderater Demenz sollen nun klären, ob Masitinib in der Lage ist, kognitive und funktionelle Scores zu verbessern. Ähnlich weit entwickelt ist Natrium-Oligomannat (GV-971), ein aus Algen gewonnenes Molekül, das in China bereits zugelassen ist. Den europäischen und amerikanischen Arzneimittelbehörden fehlen aussagekräftige Phase-III-Studien nach westlichem Standard.
Eine Verbindung, die in mehrere Wirkstoffklassen fällt, primär allerdings neuroprotektive Effekte vermittelt, ist AR1001. Der PDE-5-Hemmer soll die Durchblutung des Gehirns optimieren und neuronale Signalwege stimulieren. Erste Phase-II-Studien waren positiv, sodass AR1001 momentan weltweit in der Phase-III-Studie Polaris-AD evaluiert wird, um seine Wirksamkeit und Sicherheit zu bestätigen.
Metabolismus, Immunmodulation, Cognitive-Enhancement
Das aus der Diabetes- und Adipositas-Therapie bekannte Semaglutid, ein GLP-1-Agonist, wird wegen seiner angeblichen neuroinflammatorischen Modulation erforscht. In den Studien EVOKE und EVOKE+ wollte man herausfinden, ob orales Semaglutid bei früh-symptomatischer Alzheimer-Demenz bzw. leichter kognitiver Beeinträchtigung das Fortschreiten der Erkrankung hinauszögert. Beide Phase-III-Studien waren randomisiert, doppelblind und umfassten zusammen 3.808 Teilnehmer:innen im Alter von 55–85 Jahren. Oralem Semaglutid gelang es, gemessen am Clinical Dementia Rating, über eine Studiendauer von zwei Jahren nicht, das Fortschreiten der Erkrankung aufzuhalten.
Piromelatin wirkt als Agonist an Melatonin- und Serotonin-Rezeptoren und ist eigentlich ein Mittel gegen Schlafstörungen. Da es möglicherweise kognitionsverbessernde Eigenschaften besitzt, wird es derzeit in einer Phase-II/III-Studie hinsichtlich Gedächtnisfunktion und Alltagsfähigkeit bei Patient:innen mit milder Demenz vom Alzheimertyp begutachtet.
ACD856 lässt sich in die Wirkstoffgruppe der Neuroenhancer einordnen. Diese oft abwertend als „Hirndoping-Mittel“ bezeichneten Substanzen steigern geistige Fähigkeiten wie Konzentration, Informationsverarbeitung und Aufmerksamkeit. ACD856 fungiert als positiver allosterischer Trk-Rezeptor-Modulator, was die neuronale Plastizität und synaptische Funktion steigern kann.
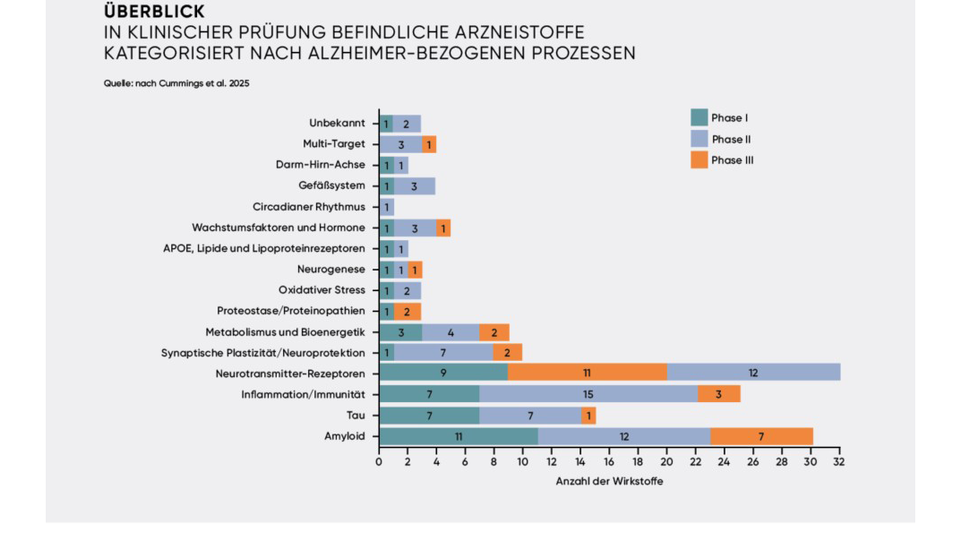
Weitere Ansätze umfassen Gen-Therapien für genetische frontotemporale Demenz (z. B. FTD-GRN, AVB-101), anti-Galectin-3-Antikörper (z. B. TB006), Sigma-2-Rezeptorantagonisten (z. B. Zervimesin) sowie CD33-Inhibitoren (z. B. Lintuzumab). Abbildung 1 (rechts) liefert einen Überblick von in klinischer Prüfung befindlichen Arzneistoffen.
Ausblick
Das Gehirn hat zum Zeitpunkt der Krankheitsmanifestation bereits über Jahrzehnte Amyloid-Pathologie, Neurodegeneration, vaskuläre und andere Veränderungen ertragen, bis es an die Grenzen seiner kognitiven Reserven gelangt ist. Es erscheint unrealistisch, zu diesem späten Zeitpunkt eine funktionelle Wiederherstellung zu erwarten. Die größte Herausforderung wird es daher sein, kausale Interventionen ähnlich der Therapie von Bluthochdruck bei noch asymptomatischen Risikopersonen zu etablieren. Ein Ziel, das nur durch ein personalisiertes und biomarkerbasiertes Vorgehen erreichbar ist.
Quellen
• Blennow K, Zetterberg H: Biomarkers for Alzheimer's disease: current status and prospects for the future. J Intern Med 2018;284(6):643-663
• Congdon EE, Sigurdsson EM: Tau-targeting therapies for Alzheimer disease. Nat Rev Neurol 2018;14(7):399-415
• Cummings JL, Zhou Y, Lee G et al.: Alzheimer's disease drug development pipeline: 2025. Alzheimers Dement (N Y) 2025;11(2):e70098
• Gründer B, Benkert O: Handbuch der psychiatrischen Pharmakotherapie (2012); 2. Auflage, Springer Verlag, Berlin-Heidelberg
• Kashif M, Sivaprakasam P, Vijendra P et al.: A recent update on pathophysiology and therapeutic interventions of alzheimer's disease. Curr Pharm Des 2023;29(43):3428-3441
Weitere Literatur auf Anfrage