Personalisierte Medizin beschreibt einen Ansatz, bei dem genetische, molekulare, klinische und umweltbedingte Informationen kombiniert werden, um Diagnostik, Therapie und Prävention individuell anzupassen.1 Ziel ist es, jedem/jeder Patient:in die richtige Therapie in der richtigen Dosis zur richtigen Zeit zu geben. Diese Entwicklung verändert nicht nur die Forschung und Arzneimittelentwicklung, sondern auch das Selbstverständnis medizinischer Praxis.2 Pharmakogenetik und -genomik ermöglichen eine Anpassung der Pharmakotherapie an genetische Polymorphismen, wodurch Wirksamkeit und Sicherheit verbessert werden können.3 Die Umsetzung dieser Ansätze birgt jedoch ethische, regulatorische und infrastrukturelle Herausforderungen.
Von der Genomforschung zur Präzisionsmedizin
Der entscheidende Impuls für die personalisierte Medizin kam mit der Entschlüsselung des menschlichen Genoms im Jahr 2003. Das „Human Genome Project“ zeigte, dass genetische Variationen maßgeblich beeinflussen, wie Menschen auf Krankheiten und Medikamente reagieren.4
Dank moderner Sequenzierungstechniken, insbesondere des Next-Generation-Sequencing (NGS), kann heute das gesamte Erbgut eines Menschen innerhalb weniger Stunden analysiert werden. Während eine Genomsequenzierung im Jahr 2001 noch über 100 Millionen US-Dollar kostete, sind es heute weniger als 1.000.5 Diese technologische Revolution machte es möglich, genetische Unterschiede zu identifizieren, die Einfluss auf Krankheitsrisiken oder das Ansprechen auf Medikamente haben.
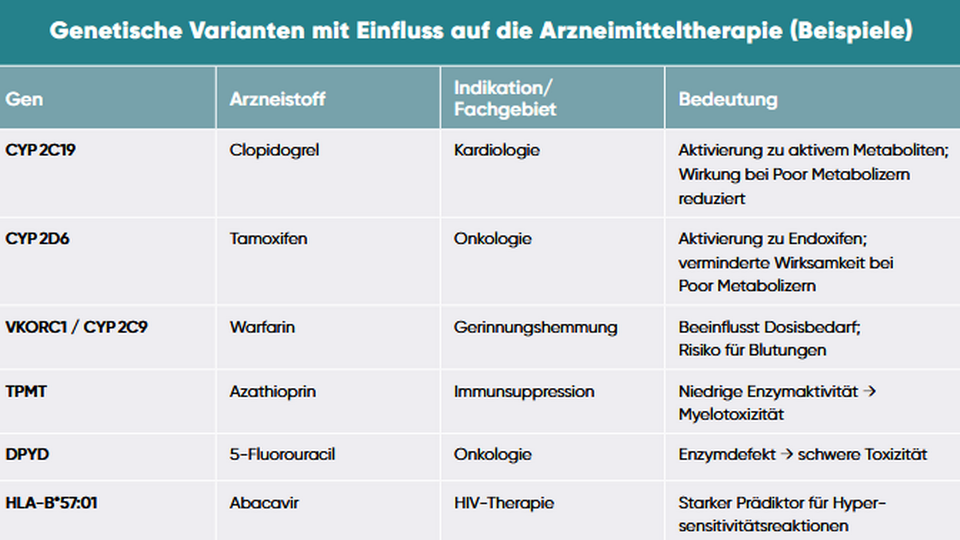
Die Pharmakogenomik beschäftigt sich mit dem Einfluss genetischer Varianten auf die Arzneimittelwirkung.3 Ein klassisches Beispiel ist das Enzym CYP 2C19, das u. a. für die Verstoffwechselung des Gerinnungshemmers Clopidogrel verantwortlich ist. Bei Personen mit einer bestimmten Genvariante (Poor Metabolizer) wird das Medikament nicht ausreichend aktiviert, wodurch die antithrombotische Wirkung ausbleibt.6 Ebenso beeinflussen Varianten in CYP 2D6 die Wirksamkeit von Tamoxifen, während Polymorphismen in VKORC1 und CYP 2C9 die optimale Warfarin-Dosis bestimmen.7
Biomarker in Diagnostik und Therapie
Ein zentrales Instrument der personalisierten Medizin sind Biomarker – messbare biologische Parameter, die Auskunft über Krankheitsprozesse oder Therapieansprechen geben. Es werden folgende Biomarker unterschieden:
• Diagnostisch – um Krankheiten zu erkennen (z. B. PSA bei Prostatakarzinom)
• Prädiktiv – um die Wirkung einer Therapie vorherzusagen (z. B. HER2 bei Brustkrebs, EGFR-Mutationen bei nicht-kleinzelligem Lungenkarzinom)
• Prognostisch – um den Krankheitsverlauf einzuschätzen (z. B. KRAS bei Darmkrebs)
In der Onkologie sind Biomarker heute unverzichtbar. So sprechen beispielsweise HER2-positive Brustkrebspatientinnen besonders gut auf den Antikörper Trastuzumab an.8 Beim nicht-kleinzelligen Lungenkarzinom wiederum kann eine Mutation im EGFR-Gen über den Einsatz gezielter Tyrosinkinasehemmer entscheiden.9
Zunehmend werden auch Liquid Biopsies genutzt, bei denen Tumor-DNA im Blut nachgewiesen wird – ein minimalinvasives Verfahren, das eine frühzeitige Erkennung von Rückfällen ermöglicht.10
Gensequenzierung und molekulare Diagnostik
Die Einführung der Next-Generation-Sequencing-(NGS-)Technologien hat die Kosten und Dauer der Genomsequenzierung stark reduziert. Whole-Genome-Sequencing (WGS) und Whole-Exome-Sequencing (WES) erlauben die Identifikation krankheitsassoziierter Varianten und können als Basis diagnostischer und therapeutischer Entscheidungen dienen5.
Omics-Technologien
Neben der Genomik erweitern Transkriptomik, Proteomik und Metabolomik die Analyseebenen. Diese multidimensionale Datenerfassung ermöglicht eine umfassende Charakterisierung biologischer Systeme („Systems Medicine“).11 Die Integration dieser Daten führt zur Identifikation von molekularen Endotypen und potenziellen Arzneimittelzielen.
Das Fundament Big Data
Die Erfassung genetischer, klinischer und lebensstilbezogener Daten erzeugt enorme Datenmengen: sogenannte Big Data. Diese Informationen stammen aus unterschiedlichsten Quellen: Genomdaten, elektronischen Patientenakten, Laborwerten, Wearables (tragbare elektronische Geräte, die am Körper getragen werden und Daten über den/die Nutzer:in sammeln, verarbeiten oder anzeigen) sowie Umweltinformationen.12 Ihre Integration erfordert standardisierte Schnittstellen und semantische Interoperabilität, also die Fähigkeit von verschiedenen IT-Systemen, Organisationen oder Anwendungen, Daten nicht nur auszutauschen, sondern diese auch inhaltlich gleich zu verstehen und korrekt zu interpretieren.
Um aus diesen Daten nutzbares Wissen zu gewinnen, kommen moderne Analyseverfahren wie künstliche Intelligenz (KI) und maschinelles Lernen (ML) zum Einsatz. Algorithmen identifizieren Muster, erkennen Zusammenhänge und treffen Vorhersagen, etwa über Krankheitsverläufe oder Medikamentenwirkungen. Random-Forest-Modelle, Support-Vector-Machines oder neuronale Netze identifizieren Zusammenhänge zwischen genetischen Varianten und klinischen Outcomes.13
KI-Systeme in der Radiologie sind in der Lage, Bilddaten auszuwerten, Tumoren frühzeitig zu erkennen oder Therapieerfolge vorauszusagen. In der Pharmakologie analysieren lernende Systeme klinische Datenbanken, um potenzielle Arzneistoffe zu identifizieren oder Nebenwirkungen vorherzusagen.14
Gleichzeitig stellt die Integration dieser Daten enorme Anforderungen an Datenschutz, Interoperabilität und Rechenleistung. Daten müssen anonymisiert, sicher gespeichert und in standardisierten Formaten ausgetauscht werden, um weltweit vergleichbar zu sein.15 Die Herausforderungen, valide Daten zu gewinnen, umfassen somit Datenheterogenität und Reproduzierbarkeit.
Ethische und regulatorische Aspekte
Datenschutz
Genetische Informationen sind hochsensibel
und können Rückschlüsse auf Familienmitglieder erlauben. Datenschutzrichtlinien wie die DSGVO (EU 2016/679) fordern explizite Einwilligungen für Nutzung und Weitergabe genetischer Daten.16
Gerechtigkeit und Zugang
Der Zugang zu genetischer Diagnostik und personalisierter Therapie ist derzeit ungleich verteilt. Kosten, technische Infrastruktur und Expertise bestimmen die Verfügbarkeit.17 Eine gerechte Implementierung erfordert gesundheitspolitische Maßnahmen und Bildungsoffensiven.
Verantwortlichkeit und Transparenz
Die zunehmende Nutzung algorithmischer Entscheidungssysteme stellt Fragen nach Verantwortung und Nachvollziehbarkeit. Black-Box-Modelle (Anm.: ein System, bei dem man zwar Eingaben und Ausgaben kennt, aber nicht genau versteht, wie ein KI-Modell zu seinen Entscheidungen kommt) sind problematisch, wenn klinische Entscheidungen nicht nachvollzogen werden können.18 Generell müssen bei der Entwicklung Risikofaktoren wie algorithmische Fehler oder die Transparenz der Modelle immer mitberücksichtigt und abgewogen werden. Validierung im Real-World Setting ist dafür essenziell.
CPIC – Pharmakogenetik in der Praxis
Während viele Bereiche der personalisierten Medizin noch in der Forschungsphase sind, hat sich die Pharmakogenetik bereits klinisch etabliert. Mehrere medizinische Fachgesellschaften, darunter das Clinical Pharmacogenetics Implementation Consortium (CPIC), geben Leitlinien heraus, welche genetischen Tests vor einer Arzneimitteltherapie sinnvoll sind.19
Personalisierte Medizin in der Prävention
Durch die Kombination genetischer, epigenetischer und Umweltfaktoren lassen sich individuelle Risiko-Scores („Polygenic Risk Scores“, PRS) ableiten. Sie dienen der Identifikation von Hochrisikopersonen für Herz-Kreislauf-, Stoffwechsel- oder Krebserkrankungen.20 Besonders außerhalb des onkologischen Umfelds ist der Routineeinsatz dafür aber noch begrenzt.
Personalisierte Prävention umfasst gezielte Screening-Programme, lifestyle-basierte Interventionen und pharmakologische Prophylaxen bei genetischer Prädisposition. Beispielhaft ist die BRCA-Mutationsanalyse, die zu präventiven Maßnahmen wie intensiviertem Screening oder prophylaktischer Mastektomie führen kann.21
Während individualisierte Prävention langfristig Kosten senken und Morbidität reduzieren kann, ist die Evidenz für viele genetisch basierte Präventionsstrategien noch begrenzt.22
Perspektiven und Herausforderungen
Die Zukunft der personalisierten Medizin liegt in der Integration multipler Datenebenen und der Etablierung standardisierter, ethisch verantwortlicher Dateninfrastrukturen. Pharmazeut:innen könnten in Zukunft zunehmend als Schnittstelle zwischen molekularer Diagnostik und klinischer Anwendung agieren.
Innovative Ansätze wie Real-world-data-Analysen und KI-gestützte Therapiesimulationen könnten eine neue Generation datengetriebener Arzneimittelentwicklung ermöglichen.23 Dennoch bleibt die Gewährleistung von Datenqualität, Sicherheit und Chancengleichheit eine Grundvoraussetzung.
Fazit
Die personalisierte Medizin markiert eine tiefgreifende Transformation der Gesundheitsversorgung. Für die Pharmazie bedeutet sie den Übergang von standardisierten Therapien zu individuell gesteuerten Arzneimittelstrategien. Pharmakogenomische Erkenntnisse, Big-Data-Analysen und Biomarker-Forschung schaffen neue Möglichkeiten, aber auch neue Verantwortlichkeiten. Zukünftige Entwicklungen müssen wissenschaftliche Evidenz, ethische Standards und gerechte Zugänglichkeit in Einklang bringen. Nur dann kann die personalisierte Medizin ihr Potenzial entfalten.
Quellen
1 Collins FS, et al.: A new initiative on precision medicine. N Engl J Med 2015; 372(9): 793–795
2 Mirnezami R, et al.: Preparing for precision medicine. N Engl J Med 2012; 366(6): 489–491
3 Relling MV, et al.: Pharmacogenomics in the clinic. Nature 2015; 526(7573): 343–350
4 Lander ES: Initial impact of the sequencing of the human genome. Nature 2011; 470(7333): 187–197
5 Shendure J, et al.: The origins, determinants, and consequences of human mutations. Science 2015; 349(6255): 1478–1483
Weitere Literatur auf Anfrage
Sabine_Klimpt.jpg)