Der menschliche Darm ist Heimat für Billionen Mikroorganismen, Bakterien, Viren, Pilzen und Archaeen, die mit uns in enger Symbiose leben und als Darmmikrobiota oder Darmflora bezeichnet werden. Diese Mikroorganismen sind nicht nur für Verdauungsprozesse und die Versorgung mit Nährstoffen essenziell, sondern spielen auch eine zentrale Rolle bei der Entwicklung und Regulation des Immunsystems. Schätzungen zufolge befinden sich bis zu 70 % aller Immunzellen im darmassoziierten lymphatischen Gewebe.
Entwicklung und Störungen der Mikrobiota
Das Darmmikrobiom entwickelt sich ab der Geburt und unterliegt lebenslangen Veränderungen durch Ernährung, Medikamenteneinnahme und weitere Umweltfaktoren. Ein gesundes Mikrobiom zeichnet sich durch eine hohe mikrobielle Diversität aus. Dadurch fungiert es als ein natürlicher Immuntrainer und hilft dem Immunsystem zu lernen, zwischen harmlosen und schädlichen Reizen zu unterscheiden. Gerät dieses System aus dem Gleichgewicht, etwa durch Antibiotikaeinnahme, einseitige Ernährung oder chronischen Stress, spricht man von einer Dysbiose. Solche Störungen werden mit einer erhöhten Anfälligkeit für Infektionen sowie immunvermittelten Erkrankungen wie Asthma, Typ-1-Diabetes oder chronisch-entzündlichen Darmerkrankungen in Verbindung gebracht.
Erkenntnisse aus keimfreien Tiermodellen
Untersuchungen haben gezeigt, dass eine intakte Darmmikrobiota für die normale Entwicklung des intestinalen wie auch systemischen Immunsystems unerlässlich ist. Keimfreie Mäuse, die unter sterilen Bedingungen aufgezogen werden und keinerlei mikrobieller Besiedelung ausgesetzt sind, weisen ausgeprägte Defizite in der Ausbildung und Funktion ihres Immunsystems auf. So ist das darmassoziierte lymphatische Gewebe unterentwickelt und die Anzahl und Reifung wichtiger Immunzelltypen wie regulatorischer T-Zellen, dendritischer Zellen oder IgA-produzierender Plasmazellen ist stark vermindert. Auch die zelluläre Immunantwort bleibt abgeschwächt, die Zytokinproduktion ist gestört und die Fähigkeit zur Abwehr pathogener Erreger ist eingeschränkt. Ohne den permanenten Kontakt zu kommensalen Mikroorganismen fehlen dem Immunsystem entscheidende Stimuli zur Differenzierung, Aktivierung und Regulation. Erst durch die vielfältigen Signale der Mikrobiota wird das Immunsystem „trainiert“, um zwischen harmlosen und gefährlichen Reizen zu unterscheiden.
Barrierefunktion und Schleimhautschutz
Der Darm als eine hochkomplexe Immunregion bildet eine Kontaktfläche zwischen Umwelt und Immunsystem. Die mit dem Menschen in Symbiose lebenden Mikroorganismen stärken die physikalische Schutzfunktion der Darmschleimhaut auf mehreren Ebenen. So fördern sie die Expression von Tight Junction‑Proteinen, welche die epitheliale Zellschicht abdichten und die Schleimproduktion durch Becherzellen stimulieren. Eine intakte Schleimhautbarriere verhindert das Eindringen potenziell immunaktivierender Substanzen wie Toxinen oder Pathogenen und bildet damit die Basis der mukosalen Immunabwehr.
Kolonisationsresistenz: Natürlicher Schutz vor Pathogenen
Ein weiterer wichtiger Schutzmechanismus ist die sogenannte Kolonisationsresistenz. Diese umfasst mehrere Strategien: Die kommensalen Mikroorganismen konkurrieren mit potenziellen Pathogenen um Nährstoffe und Bindungsstellen im Darmepithel, wodurch deren Ansiedlung effektiv verhindert wird. Zudem produzieren sie antimikrobielle Substanzen wie Bakteriozine, die gezielt pathogene Bakterien hemmen, während die physiologische Darmflora weitgehend geschont bleibt.
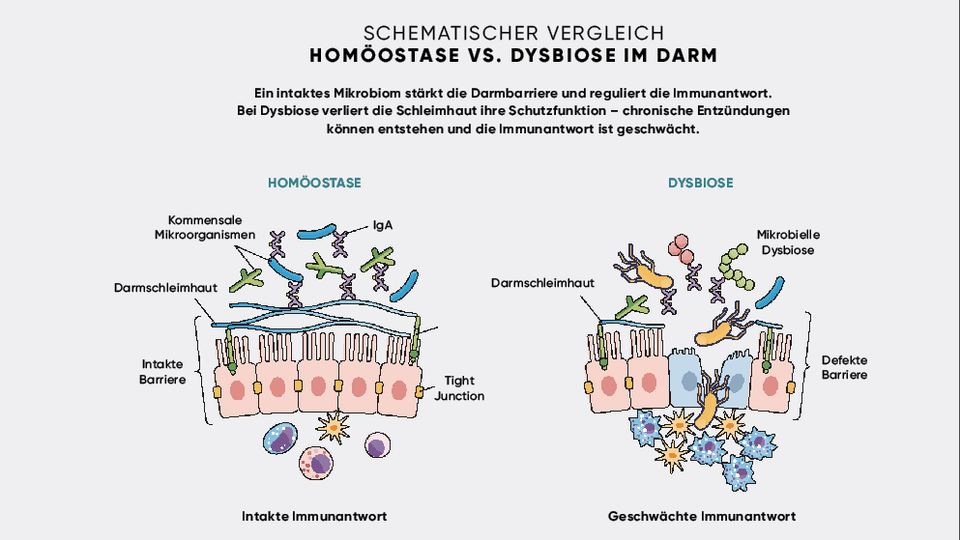
Auch die von der Mikrobiota erzeugten kurzkettigen Fettsäuren leisten einen wichtigen Beitrag, indem sie das intestinale Milieu ansäuern und so das Wachstum pathogener, säureempfindlicher Keime unterdrücken. Ein weiterer Schutzfaktor ist die Aufrechterhaltung anaerober Bedingungen im Darm, die insbesondere die Überlebensfähigkeit sauerstoffabhängiger Pathogene beeinträchtigen. Wird diese mikrobiell vermittelte Abwehr gestört, steigt das Risiko für Infektionen deutlich an, wie z. B. bei einer Überbesiedelung mit Clostridioides difficile, die zu Antibiotika-assoziierter Diarrhoe führt.
Immunmodulation durch mikrobielle Metabolite
Das intestinale Mikrobiom übernimmt weit mehr als nur Barriere- und Schutzfunktionen – es greift aktiv in immunologische Prozesse ein. Besonders bedeutsam sind hierbei die kurzkettigen Fettsäuren (SCFA) Acetat, Propionat und Butyrat, die entstehen, wenn Darmbakterien unverdauliche Kohlenhydrate aus der Nahrung, insbesondere Ballaststoffe, fermentieren. Diese bakteriellen Stoffwechselprodukte entfalten weitreichende immunmodulierende Wirkungen: Sie fördern die Differenzierung regulatorischer T-Zellen (Tregs), die für die Aufrechterhaltung der Immuntoleranz essenziell sind. Außerdem beeinflussen sie die Zytokinproduktion verschiedener Immunzelltypen und tragen somit zur Balance zwischen pro- und antiinflammatorischen Signalen bei. Butyrat zeigt hierbei besonders ausgeprägte entzündungshemmende Eigenschaften, da es die Aktivierung des Transkriptionsfaktors NF‑κB hemmt und dadurch die Expression zahlreicher proinflammatorischer Zytokine und Chemokine reduziert. Gleichzeitig begünstigt es die Reifung dendritischer Zellen.
Insgesamt zeigt sich ein komplexes, aber gut abgestimmtes Zusammenspiel verschiedener Mechanismen. Das Mikrobiom schützt die Darmschleimhaut strukturell, verhindert die Besiedelung durch Pathogene und beeinflusst aktiv die Funktion des Immunsystems. Eine Dysbiose kann dieses System aus dem Gleichgewicht bringen und wird mit einer Vielzahl immunvermittelter Erkrankungen in Verbindung gebracht, darunter chronisch-entzündliche Darmerkrankungen oder Autoimmunerkrankungen.
Therapeutische Ansätze: Probiotika & Präbiotika
Die Bedeutung des Darmmikrobioms für das Immunsystem und die Entstehung von Krankheiten wird inzwischen gezielt in Prävention und Behandlung miteinbezogen.
Probiotika, also lebende Mikroorganismen mit gesundheitsfördernder Wirkung, werden beispielsweise erfolgreich zur Vorbeugung von Antibiotika-assoziierter Diarrhoe und zur Stabilisierung der Darmflora nach einer antibiotischen Therapie eingesetzt. Auch in der Prävention von Neurodermitis bei Kindern zeigen bestimmte probiotische Stämme, vor allem Lactobacillus rhamnosus, vielversprechende Effekte, insbesondere bei frühzeitiger Anwendung im Säuglingsalter. Trotz der nachgewiesenen Wirksamkeit bestimmter Probiotikastämme bei spezifischen Indikationen fehlen bislang überzeugende wissenschaftliche Belege dafür, dass die tägliche Einnahme von Probiotika bei gesunden Menschen einen nachhaltigen gesundheitlichen Nutzen bringt. Neben der probiotischen Therapie kommen zunehmend auch Präbiotika zum Einsatz. Das sind Ballaststoffe, die gezielt das Wachstum günstiger Bakterien fördern, etwa von Bifidobakterien oder Laktobazillen. Inzwischen werden auch Synbiotika (Kombination aus Pro- und Präbiotika) sowie neuartige Ansätze wie Postbiotika (nicht lebende mikrobielle Produkte) erforscht.
Vielversprechend: Fäkale Mikrobiota-Transplantation
Einen besonderen Stellenwert in der Therapie schwerer Dysbiosen nimmt die fäkale Mikrobiota-Transplantation (FMT) ein, auch Stuhltransplantation genannt. FMT ist ein Verfahren, bei dem das Darmmikrobiom einer gesunden Person auf eine/n kranke/n Patienten/Patientin übertragen wird. Dadurch soll sich die Darmflora des/der Patient:in normalisieren, insbesondere nach einer Dysbiose oder durch eine Erkrankung. Sie hat sich insbesondere bei rezidivierenden Infektionen mit Clostridioides difficile als hochwirksam erwiesen und findet zunehmend auch bei chronisch-entzündlichen Darmerkrankungen Anwendung.
Diagnostische Perspektiven: Mikrobiom als Biomarker
Das Mikrobiom zeigt sich auch als vielversprechender Biomarker in der Diagnostik von Krankheiten. Veränderungen in der Zusammensetzung und Diversität der Mikrobiota korrelieren mit Krankheitsaktivität, etwa bei Morbus Crohn, Typ-2-Diabetes oder bestimmten Tumorarten. Dabei könnten in Zukunft bestimmte Krankheiten schon frühzeitig erkannt werden, noch bevor sich die ersten Symptome bemerkbar machen. Die Integration mikrobiombasierter Analysen in der personalisierten Therapie gilt daher als vielversprechender Ansatz für die Präzisionsmedizin der Zukunft.
Fazit und Ausblick
Das Darmmikrobiom ist weit mehr als ein passiver Mitbewohner. Es ist ein wesentlicher Bestandteil des menschlichen Immunsystems. Die komplexen Wechselwirkungen zwischen Mikroben, Immunzellen und epithelialen Strukturen sind zentral für die Aufrechterhaltung der Immunhomöostase und die Abwehr von Krankheitserregern. Gleichzeitig eröffnen sie neue Perspektiven für Prävention, Diagnostik und Therapie zahlreicher Erkrankungen. Erste Erkenntnisse und Anwendungen im klinischen Alltag lassen erahnen, welches Potenzial in der gezielten Beeinflussung der Darmflora liegt. Zukünftige Studien sollten besser verstehen, wie probiotische Bakterienstämme genau wirken, und gezielt Therapien erforschen, bei denen das Mikrobiom als Teil der Behandlung miteinbezogen wird.
Quellen
• Wiertsema SP, et al.: The interplay between the gut microbiome and the immune system in the context of infectious
diseases throughout life and the role of nutrition in optimizing treatment strategies. Nutrients 2021; 13(3): 886
• Zheng D, et al.: Interaction between microbiota and immunity in health and disease. Cell Res 2020; 30: 492–506
• Carding S, et al.: Dysbiosis of the gut microbiota in disease. Microb Ecol Health Dis 2015; 26: 26191.
• Rooks MG, et al.: Gut microbiota, metabolites and host immunity. Nat Rev Immunol 2016; 16(6): 341–352
• Ney LM, et al.: Short chain fatty acids: key regulators of the local and systemic immune response in inflammatory diseases and infections. Open Biol 2023; 13(3): 230014
Weitere Literatur auf Anfrage