Das Epstein-Barr-Virus (EBV) wird über Speichelkontakt oder Tröpfcheninfektionen verbreitet und bleibt nach der initialen Infektion lebenslang latent im Körper erhalten. Etwa 90 bis 95 % aller Erwachsenen weltweit sind seropositiv auf EBV-Antikörper. Die bekannteste Manifestation einer ersten EBV-Infektion ist die infektiöse Mononukleose, auch Pfeiffersches Drüsenfieber genannt. Die Erkrankung zeichnet sich zu Beginn durch Kopfschmerzen und eine erhöhte Körpertemperatur aus, bevor spezifischere Symptome wie Tonsillitis oder Pharyngitis, eine Vergrößerung der zervikalen Lymphknoten und mittleres bis hohes Fieber auftreten. Darüber hinaus kann eine EBV-Infektion jedoch auch asymptomatisch verlaufen oder diverse andere Organsysteme betreffen und unter anderem zu Pneumonie, Myokarditis, Pankreatitis, Myositis oder Glomerulonephritis führen. Als Komplikationen und schwerwiegende Folgen, die vor allem bei immunsupprimierten Personen auftreten, gelten u. a. Multiple Sklerose, Lymphome und nasopharyngeale sowie gastrale Karzinome.
Ruhende Gene in B-Zellen
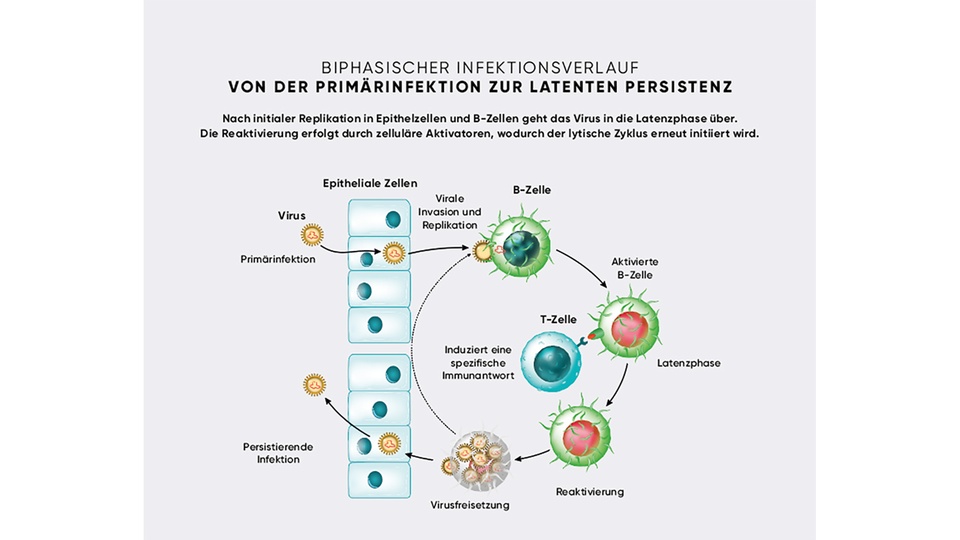
Die Replikation von EBV findet nach Eintritt über Epithelzellen in das Plasma durch die Bindung an das CD21-Oberflächenprotein in B-Lymphozyten statt, wo das Genom nach der akuten Infektion in Form von Episomen erhalten bleibt. Dadurch kommt es zur typischen latenten Infektion, die sich durch die virale Persistenz in der Zelle, eine eingeschränkte Virusexpression und ein gleichzeitig erhaltenes Potenzial für die Reaktivierung der lytischen Replikation auszeichnet. Dieser Ruhestatus kann durch die Induktion zellulärer Aktivatoren wie BZLF1 und BRLF1 (regulieren die Expression mehrerer, für die Replikation relevanter EBV-Gene) unterbrochen werden, was in Folge zur erneuten Produktion und Freisetzung von Viren aus der Wirtszelle führt.
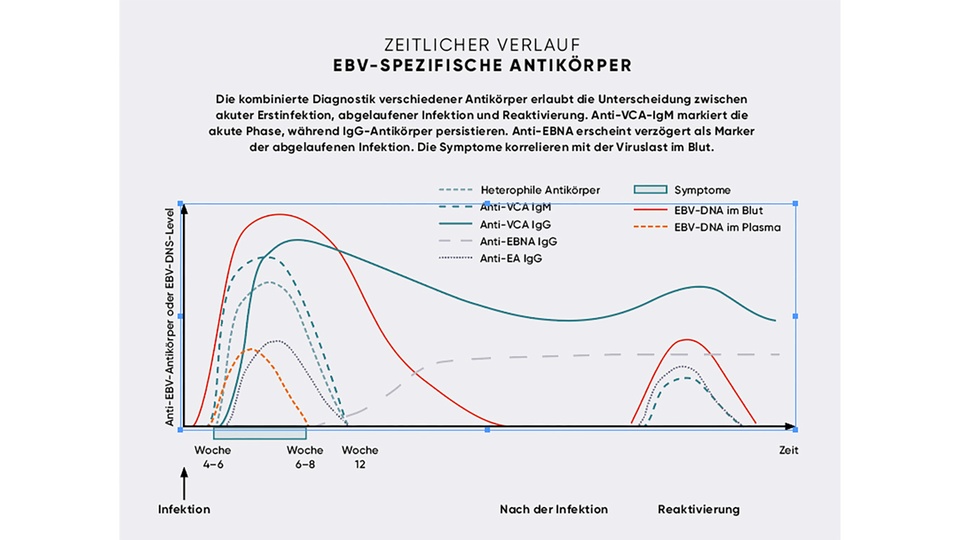
Verschiedene Antikörper charakterisieren den Infektionsverlauf
Um eine EBV-Infektion oder die Reaktivierung zu detektieren, stehen mehrere Nachweisverfahren zur Verfügung. Anti-VCA-IgM-Antikörper (VCA = Virus-Capsid-Antigen) treten früh auf und verschwinden nach vier bis sechs Wochen wieder, IgG-Antikörper erreichen ihre Spitze hingegen nach zwei bis vier Wochen und sind danach ein Leben lang nachweisbar. Anti-EA-IgG-Antikörper (EA = early antigen) treten ebenfalls in der akuten Phase auf, fallen jedoch nach drei bis sechs Monaten in den nicht nachweisbaren Bereich. Antikörper gegen das EBV nuclear antigen (EBNA) erscheinen hingegen erst zwei bis sechs Monate nach der Infektion, da das nukleäre Antigen erst nach dem Abschluss des initialen lytischen Zyklus exprimiert wird. Diese Antikörper bleiben wiederum latent im Körper erhalten und können diagnostisch zum Ausschluss einer akuten EBV-Infektion herangezogen werden.

Eine Reaktivierung des EBV mit erneutem Krankheitsausbruch tritt im Gegensatz zu anderen bekannten Herpesviren nicht sehr häufig auf, da das Immunsystem die latente Infektion bei gesunden Personen u. a. durch zytotoxische T-Zellen in Schach hält. Bei immunsupprimierten Patient:innen kann EBV jedoch ungehindert wieder in den lytischen Zyklus und somit in die Replikation übergehen. Es wird bei dieser Gruppe u. a. mit aggressiven lymphoproliferativen Erkrankungen und aufgrund des Vorliegens in oralen Epithelzellen mit oraler Haarleukoplakie (weißliche Streifen an den Zungenrändern) in Verbindung gebracht. Mit EBV infizierte B-Zellen gelten grundsätzlich als onkogen, da sie sich bei der Kultivierung in vitro unbegrenzt vermehren.
Stress greift in die Regulation des Immunsystems ein
Was genau die Reaktivierung des EBV in vivo triggert, ist nicht genau bekannt, allerdings wird u. a. ein Zusammenhang mit Co-Infektionen und einer damit einhergehenden B-Zell-Rezeptor-Simulation vermutet. So gibt es u. a. Untersuchungen zur EBV-Reaktivierung nach einer COVID-19-Infektion und den Zusammenhängen mit der Entwicklung von Long-COVID-Symptomen. Dass auch psychischer und physischer Stress eine Rolle in der Reaktivierung von Viren spielen kann, wird in der Literatur immer wieder beschrieben. Dabei zeigt die Forschung im Bereich der Psychoneuroimmunologie unter anderem, dass mentaler Stress die Interaktion zwischen dem Nerven- und Immunsystem stören und zu einer immunologischen Dysregulation führen kann. Neben einer verminderten Immunantwort auf Impfungen, langsamerer Wundheilung und einem erhöhten Infektionsrisiko ist auch die Reaktivierung von Herpesviren wie dem EBV mit diesen Prozessen assoziiert. Es wird u. a. davon ausgegangen, dass durch Stress ein Shift vom Th1- zum Th2-Pathway stattfindet, wodurch die Produktion von für die T-Zell-Antwort wichtigen Zytokinen herunterreguliert wird.
Eine Studie an Astronaut:innen zeigte beispielsweise, dass die Konzentration von EBV-DNA sowie die Cortisol- und Katecholaminspiegel während des mental belastenden Tages der Landung am höchsten waren. Es wurden dafür Speichelproben vor, während und nach dem Raumflug sowie jene von Kontrollgruppen abgenommen. Auch in einer prospektiven Beobachtungsstudie an Frauen in der Spätschwangerschaft war das Stresslevel mit erhöhten EBV-VCA-IgG-Antikörpern assoziiert. Weitere Studien an einer geriatrischen japanischen Population und an amerikanischen Jugendlichen zeigten einen ähnlichen Zusammenhang, jedoch jeweils nur bei weiblichen Personen. Der Grund für diesen Geschlechtsunterschied ist bisher unbekannt, es wird jedoch ein Zusammenspiel aus inflammatorischen, immunologischen und endokrinologischen Faktoren vermutet.
Auch wie eine Person individuell auf Stressoren reagiert und damit umgeht, dürfte einen Einfluss auf die Immunantwort und infolgedessen auf eine mögliche Reaktivierung haben. So konnte in einer Studie gezeigt werden, dass ein stärkerer Cortisolanstieg mit einem höheren Antikörpertiter von EBV-VCA-IgG einherging. Ein Anstieg der auch in der latenten Phase immer nachweisbaren VCA-Antikörper kann als Anzeichen für die bei der Reaktivierung vermehrte Antigensynthese interpretiert werden.
Die Rolle von IGF-I und der Stressbewältigung
Eine spezielle Rolle bei der Reaktivierung von EBV könnte auch der insulin-like growth factor I (IGF-I) spielen, dessen Spiegel vor allem bei Frauen mit dem Alter abnimmt. In Experimenten an Mäusen korrelierte der IGF-I-Spiegel im Serum negativ mit Angstverhalten durch das erhöhte Pluslabyrinth (einer Apparatur, die vor allem bei Nagetieren durch ihre Höhe und Offenheit Angst hervorrufen soll). Auch beim Menschen wurde diese Korrelation bereits beobachtet, was auf eine protektive Wirkung von IGF-I in Stresssituationen hindeuten könnte. IGF-I reguliert außerdem auf verschiedene Weisen die Funktion von T-Zellen, B-Zellen und Monozyten und könnte daher auch eine regulierende Wirkung auf die EBV-Reaktivierung haben.
Studienergebnisse deuten des Weiteren auf einen positiven Einfluss von effektiven Bewältigungsstrategien hin. Aktivitäten wie Sport im aeroben Bereich und die Teilnahme an Freizeitaktivitäten können sowohl depressive Symptome als auch die stressinduzierte Immundysregulation mindern. Negative bzw. ineffektive Coping-Strategien, die zwar kurzfristig zu einer Symptomlinderung führen, sich langfristig aber ungünstig auswirken, können hingegen negativ mit der Funktion des Immunsystems korrelieren. Dazu zählen Isolation, Substanzmissbrauch oder zwanghafte Verhaltensweisen. Wie stark der Zusammenhang dieser Faktoren mit dem Risiko für eine EBV-Reaktivierung genau ist, muss jedoch durch weitere Forschung noch genauer geklärt werden. Eines zeigt sich jedoch bereits jetzt: Der Einfluss der Psyche auf das Immunsystem ist signifikant, aber oft nicht monokausal und durch verschiedene individuelle Faktoren beeinflussbar.
Quellen
• Centers for Disease Control and Prevention (CDC): Laboratory testing for Epstein-Barr virus (EBV). Abgerufen am 08.08.2025
• Ford J et al.: Depressive symptoms are associated with salivary shedding of Epstein-Barr virus in female adolescents:
The role of sex differences. Psychoneuroendocrinology. 2017; 86:128-133
• Gold JE et al.:Investigation of Long COVID prevalence and its relationship to Epstein-Barr virus reactivation. Pathogens. 2021; 10(6), 763.
• Lupo et al.: Virological Markers in Epstein–Barr Virus-Associated Diseases. Viruses. 2023; 15(3):656.
• Nayak T, et al.: Immune deregulation caused by stress: Implications for cancer, infectious disease and wound healing.
Int J Med Research & Health Sciences 2023; 12(5): 10-15
Weitere Quellen auf Anfrage
-Mat-Stefanic.jpg)