Eine notwendige Voraussetzung zur pharmakotherapeutischen Dosisanpassung ist deshalb die Erfassung der Leberleistungsfähigkeit. Leider ist dafür kein singulärer, präziser Parameter vorhanden, es gibt auch keinen endogenen Marker zur Quantifizierung der hepatischen Clearance. An Art und Ausmaß der veränderten hepatischen Clearance bei einer Leberinsuffizienz sind diverse Systeme beteiligt, bspw. das CYP450-System, Sulfo- und Glucuronyltransferasen sowie Kationen- und Anionentransporter. Je nach Art und Schwere der Leberschädigung kann es zu diversen Veränderungen in diesen Metabolisierungs- und Exkretionssystemen kommen. Prädiktiv sind diese Effekte nicht einfach erfassbar, sie fallen je nach Art der Leberpathologie unterschiedlich aus.
Im Wesentlichen bestimmen zwei Faktoren, wie stark sich die hepatische Clearance verändert: der hepatische Blutfluss und der Extraktionskoeffizient des Arzneistoffes bei der ersten Leberpassage, der selbst von der Affinität des Substrates zu den metabolisierenden Enzymen und deren Aktivität abhängt. Der Extraktionskoeffizient wird durch die Konzentrationen in der Portalvene und der Vena hepatica bestimmt.
Arzneistoffe (AS) mit einer niedrigen hepatischen Extraktionsrate sind besonders von Leberkapazitätsänderungen betroffen. Bei AS mit einer sehr hohen hepatischen Extraktionsrate nähert sich der Extraktionskoeffizient nahezu 1, da die hepatische Clearance ungefähr dem Blutfluss entspricht. Im Umkehrschluss wird die Extraktion dieser AS durch die Änderung des hepatischen Blutflusses limitiert. Es zeigen sich dann erhöhte Plasmakonzentrationszeitkurven und eine verlängerte Plasmahalbwertzeit. Die Dosisanpassung bei Leberinsuffizienz lässt sich nicht ohne Weiteres – wie bspw. bei Nierenfunktionseinschränkungen – berechnen. Lediglich bei rein renal eliminierten Arzneistoffen ist teilweise eine Dosisreduktion in gewissen Grenzen proportional zur Kreatinin-Clearance möglich. Auch die Veränderungen der Pharmakokinetik sind nicht linear abhängig vom Ausmaß der Veränderung der Metabolisierungsraten.
Kinetik und Leberleistungseinschätzung
Durch klinische Variablen wie Serumalbumin, Aszitesbildung, Bilirubingehalt, Quick, INR oder eine bestehende Enzephalopathie und Aszites wird der Child-Pugh-Score (CPS) ermittelt. Ursprünglich diente er dazu, prospektive Aussagen über die erwartbare operative Mortalität von Leberpatient:innen zu treffen. Der CPS eignet sich jedoch eher zur potenziellen Leberzirrhosenprognostik als zur Beschreibung der Metabolisierungsleistungseinschränkung. Je nach Punkten pro Parameter werden Klassen von A bis C erreicht, die mit bestimmten Ein- und Zweijahresüberlebensraten assoziiert sind.
Weitere Scores sind der MELD- und der MELD-Na-Score. Diese Model of End Stage Liver Disease-Scores berücksichtigten rein objektive Laborparameter wie Bilirubin, INR und Serumkreatinin und im Falle des MELD-Na-Scores auch das Serumnatrium. Ursprünglich wurden sie entwickelt, um die 3-Monats-Mortalität nach Anlage eines transjugulären intrahepatischen portosystemischen Shunts (TIPS) vorherzusagen.
Der MELD- und der MELD-Na-Score, der die Hyponatriämie als Prädiktor des Zirrhosegrades mit einbezieht, dient und diente in einigen Ländern der Priorisierung der Patient:innen auf Transplantationslisten.
Weiterführende Studien zeigten den Zusammenhang zwischen dem MELD-Score und der Mortalität verschiedener Patientengruppen, z. B. vor Operationen oder generell für hospitalisierte Patient:innen.
Über den CPS das allgemeine Ausmaß der Leberleistung abzuschätzen, ist äußerst limitiert.
Bestimmung
Um die spezifische Metabolisierungsrate/-kapazität verschiedener AS zu bestimmen, gibt es zwei Möglichkeiten:
1 Die Stratifizierung von Patient:innen mit dem Ergebnis, die genaue Enzymaktivität aller CYP-450-Enzyme zu bestimmen, oder
2 Verabreichung eines Phänotypisierungscocktails, bestehend aus fünf Substanzen (Koffein, Losartan, Omeprazol, Dextromethorphan und Midazolam) Die tagsüber gemessenen Konzentrationen im Urin sowie im Plasma ermöglichen einen Rückschluss auf die Aktivität der wichtigsten Zytochrom-Enzyme: CYP 1A2, CYP 2C9, CYP 2C19, CYP 2D6, CYP 3A4 sowie NAT-2 (N-Acetyltransferase 2) und Xanthinoxidase. Beide Methoden sind valide und einfach durchzuführende Methoden, um die Aktivität der wichtigsten Zytochrom-Enzyme zu messen. In Zukunft lassen sich so die Arzneimitteltherapien individueller durch genauere Dosierungsempfehlungen anpassen und unerwünschte Arzneimittelwirkungen reduzieren. Jedoch sind bisher diese standardisierten Prüfbedingungen wie auch analytische Voraussetzungen unter klinischen Bedingungen selten oder auch aus Kostengründen nicht verfügbar.
Pharmakokinetische Veränderungen treten von der AS-Absorption bis zur -Elimination auf und variieren stark. Theoretische, pharmakokinetische Überlegungen liefern i. d. R. nur einen Anhaltspunkt für potenzielle Dosisanpassungen, diese müssen immer im Kontext zu den potenziellen AS-Interaktionen und Nebenwirkungen betrachtet werden.
AS-Bioverfügbarkeitsveränderungen
Verminderte Metabolisierung
Durch Hepatozytenschädigungen sinkt die Umsatzrate intrinsischer, metabolisierender Enzyme wie bspw. der CYP450-Familie.
Verminderte biliäre Ausscheidung
Bei intra- und extrahepatischen Cholestasen kumulieren biliär ausgeschiedene Arzneistoffe, wie bspw. das selbst kaum metabolisierbare Rifampicin. Eine intrahepatische Cholestase entsteht durch eine Störung der Gallenbildung in den Hepatozyten. Mögliche Ursachen sind Virushepatitiden oder hepatozelluläre Karzinome.
Extrahepatische Cholestasen entstehen durch mechanische Hindernisse, wie Gallensteine in den Gallengängen, die den Abfluss der Gallenflüssigkeit verhindern.
Verminderte hepatische Durchblutung
Bei Kollateralenbildungen durch portokavale Shunts oder einer Leberzirrhose mit portaler Hypertension steigt die AS-Bioverfügbarkeit durch Umgehung der hepatischen Elimination deutlich.
Transporter
Für die Aufnahme von AS in die Hepatozyten und Freisetzung aus diesen in das Blut oder die Gallenflüssigkeit nehmen Transporter eine wichtige Rolle ein. Basolaterale Influx-Transporter (aus dem Blut in die Hepatozyten) werden bei inflammatorischen und cholestatischen Hepatopathien herunterreguliert. Transporterveränderungen auf der kanalikulären Seite (aus Hepatozyten in die Galleflüssigkeit) sind uneinheitlich und abhängig von der Schwere und Pathogenese der Fibrose/Zirrhose. Auch resultieren, je nach Art der Hepatopathie, unterschiedliche Effekte auf die Transporter, bspw. bei alkoholisch induzierten oder Hepatitis-C-bedingten Zirrhosen.
Verminderte hepatische Durchblutung
Im Rahmen einer Leberzirrhose entstehen Lebervernarbungen und ein Überdruck beim Blutinflux in die Pfortader (Vena portae). Zur Druckentlastung erfolgt häufig die Anlage eines transjugulären intrahepatischen portosystemischen Shunts (TIPS). Dieser Shunt ist eine Kurzschlussverbindung zwischen einem Pfortaderast und einem Abzweig der Lebervene und reduziert Komplikationen wie rezidivierende Ösophagusblutungen oder therapierefraktäre Aszites. Jedoch sinken dabei die Leberdurchblutung und die hepatische Metabolisierung sowie die CYP-3A4-Aktivität im Darm, wodurch die orale Bioverfügbarkeit von Pharmaka weiter steigt.
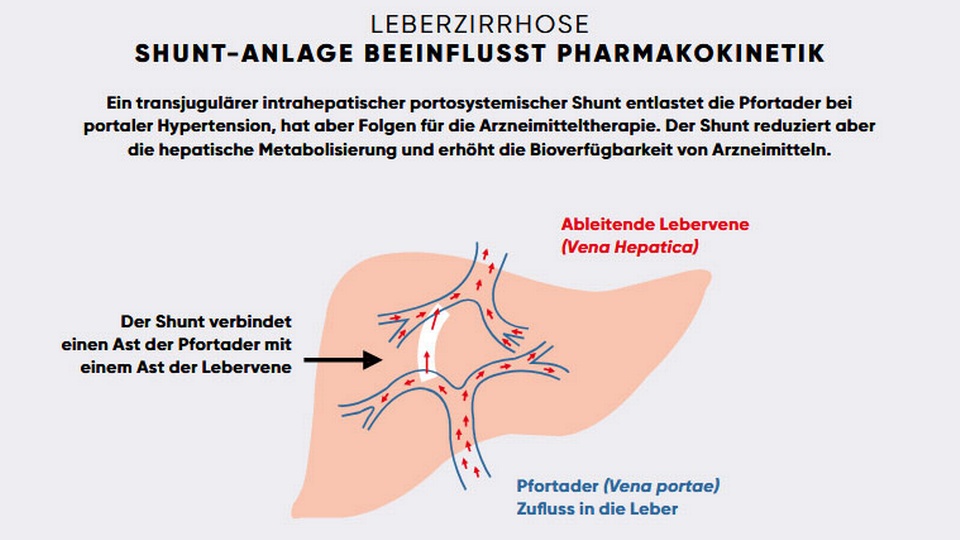
Hepatorenales Syndrom
Die veränderte Blutperfusion bei portaler Hypertonie führt zu manifesten, systemischen Blutdruckregulationsveränderungen. Die Aktivierungen des RAAS und des Sympathikus führen kausal zu einer Nierendurchblutungsverminderung. Additiv führt die renale Vasokonstriktion zu einer GFR-Senkung und folglich auch zu einer verminderten renalen Clearance. Erschwert wird zudem die Nierenfunktionsbestimmung bei Leberinsuffizienzen durch niedrige Kreatininspiegel, die aus einer reduzierten Muskelmasse resultieren.
Formeln zur Nierenfunktionsberechnung, die das Serumkreatinin einbeziehen, liegen falsch niedrig und die, die das Körpergewicht einbeziehen, bei Aszites falsch hoch.
Auch die Kreatinin-Clearance-Messung ergibt falsch hohe GFR-Werte, da neben der passiven Kreatinin-Filtration zusätzlich noch eine tubuläre Kreatinin-Sekretion vorliegt.
Cystatin-C-basierte Formeln könnten bei Leberzirrhose eine akkuratere Bestimmung der GFR ermöglichen. Cystatin C wird von den meisten kernhaltigen Zellen in relativ konstanter Rate produziert, die Produktion scheint sich sogar bei entzündlichen Prozessen und anderen pathologischen Zuständen nicht zu verändern.
Neben der Dosisanpassung an die Leberfunktion ist insbesondere bei enger therapeutischer Breite und hoher renaler Elimination eine Dosisanpassung an die Nierenfunktion obligatorisch. AS, die potenziell die Nierenfunktion weiter einschränken, sind kritisch zu hinterfragen.
Im Teil 2 werden die pharmakokinetischen und pharmakodynamischen Arzneimittelinteraktionen bei Leberinsuffizienz beleuchtet und Dosisempfehlungen gegeben.
Der direkte Kontakt zum Arbeitskreis Krankenhauspharmazie der ÖAZ per E-Mail arbeitskreis.oeaz@krankenhausapotheke.at. Wir freuen uns über Rückmeldungen und Themenvorschläge.
_GESPAG_SW.jpg)