Das kardiovaskuläre Risiko definiert die Wahrscheinlichkeit, eine kardiovaskuläre Erkrankung wie Herzinfarkt, Schlaganfall oder periphere arterielle Verschlusskrankheit zu erleiden. Das individuelle Risiko setzt sich aus verschiedenen und synergistisch wirkenden Faktoren wie Alter, Geschlecht, Blutdruck, Cholesterinspiegel, Rauchen und vorliegenden Erkrankungen wie Diabetes oder koronare Herzkrankheit (KHK) zusammen.
Zur Kalkulation des kardiovaskulären Risikos stehen verschiedene Scores zur Verfügung, die auf großen Kohortenstudien basieren. Diese Scores beziehen sich auf ähnliche Risikofaktoren, unterscheiden sich jedoch in den Charakteristika der Kohorten, dem Endpunkt und der Validierung. Sie bieten daher nur eine grobe Einschätzung des kardiovaskulären Risikos. Die S3-Leitlinie für die hausärztliche Risikoberatung zur kardiovaskulären Prävention der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin bevorzugt drei Scores für die Anwendung in der Praxis: arriba Herz, Systematic Coronary Risk Estimation 2 (SCORE2 und SCORE2-OP) und den PROCAM-Test.
Labordiagnostische Prädiktoren, die für die Berechnung dieser Scores berücksichtigt werden, umfassen das Lipidprofil (Gesamtcholesterin, Triglyceride, LDL- und HDL-Cholesterin) und den HbA1c-Wert. Die Forschung der letzten Jahre identifizierte jedoch vielversprechende Laborparameter für eine präzisere Abschätzung des kardiovaskulären Risikos (siehe Tabelle 1).

Apolipoproteine im Fokus
Lipoproteine wie HDL, VLDL und LDL sind für den Transport von hydrophoben Lipiden wie Triglyceriden und Cholesterin im Blut verantwortlich. Der Proteinanteil, der die hydrophile Oberfläche bildet und für Struktur sowie Funktion verantwortlich ist, wird als Apolipoprotein bezeichnet. Apolipoproteine werden in Leber und Darm gebildet und können in fünf Gruppen (ApoA bis E) eingeteilt werden.
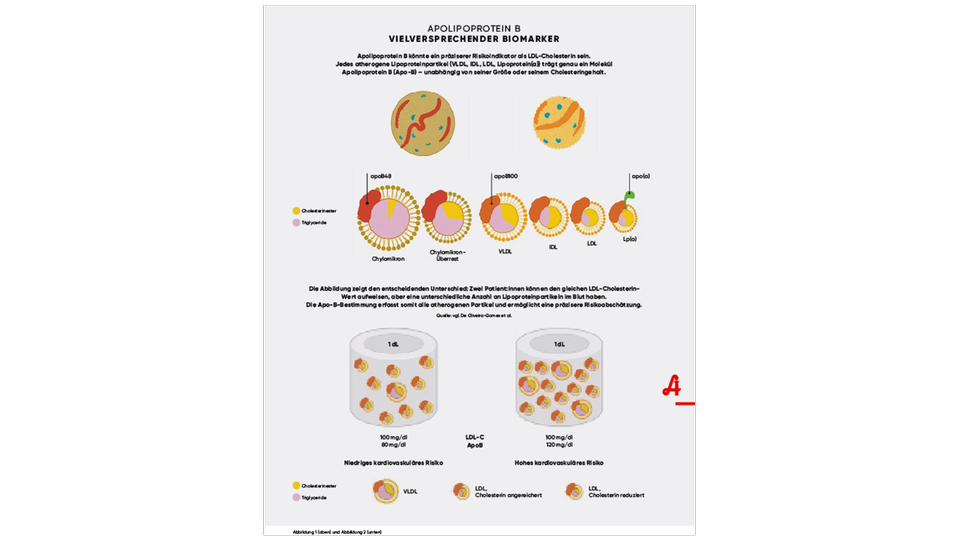
Als vielversprechender Biomarker für atherosklerotische Herz-Kreislauf-Erkrankungen gilt das Apolipoprotein B (das für die beiden Isoformen ApoB-48 und ApoB-100 steht), das mit Ausnahme von HDL in allen Lipoproteinfraktionen vorkommt und für deren Anhaftung über Proteoglykanbindungen am Endothel verantwortlich ist. Jedes der atherogenen Lipoproteine wie VLDL, IDL, LDL und Lipoprotein(a) enthält jeweils ein Molekül Apolipoprotein B-100 (siehe Abbildung 1). Je höher das Apolipoprotein B im Blut, desto höher der Anteil an atherogenen Lipoproteinen. Dieses direkte Verhältnis ermöglicht im Lipidprofil eine vereinfachte Darstellung aller zirkulierenden atherogenen Lipoproteinpartikel im Blut sowie eine verbesserte Therapiekontrolle von Dyslipidämien.
Das Rennen zwischen Apo-B und LDL-C
Die Leitlinien der American Heart Association (AHA) und European Society of Cardiology (ESC) empfehlen bereits den klinischen Einsatz von Apolipoprotein B als Biomarker, denn – trotz der engen Korrelation zwischen Apo-B und LDL-C – ist Apo-B ein präziserer Prädikator für das Risiko atherosklerotisch-kardiovaskulärer Erkrankungen: Bei gleichen LDL-C-Werten kann ein unterschiedliches kardiovaskuläres Risiko vorliegen, da nicht zwischen cholesterinarmen und cholesterinreichen Partikeln unterschieden wird. Beispielsweise haben Personen mit einer großen Anzahl cholesterinarmer Lipoproteine (hohes Apo-B) ein höheres Risiko als Personen mit einer niedrigeren Anzahl cholesterinreicher Lipoproteine (niedriges Apo-B) (siehe Abbildung 2). Weitere Vorteile sind, dass Apo-B im Vergleich zu LDL-C auch das Risiko durch andere atherogene Lipoproteine wie VLDL und IDL erfasst. Zudem wird Apo-B mit einer standardisierten Messung ermittelt und nicht wie LDL-C über verschiedene Formeln (z. B.: Friedewald-Formel: LDL-C |mg/dl] = Gesamtcholesterin – HDL-C – (Triglyceride/5)) berechnet. Eine Apo-B-Bestimmung ist daher besonders in der Beurteilung, ob Hypertriglyceridämien (≥ 200 mg/dl) atherogen sind, hilfreich. Je höher das individuelle Risiko, desto niedriger ist der Zielwert für ApoB angesetzt (siehe Tabelle 1). Für eine breite Implementierung der Apo-B-Messung fehlen jedoch noch einheitliche Empfehlungen in Bezug auf die Interpretation der Messwerte und die therapeutische Anwendung.
Die genetische Komponente
Lipoprotein(a) zählt zu den atherogenen Lipoproteinen und gilt trotz seiner Strukturähnlichkeit mit LDL-C als eigenständiger Risikofaktor für kardiovaskuläre Erkrankungen. Im Vergleich zu LDL-C trägt Lp(a) neben dem ApoB-100 auch Apolipoprotein A (ApoA), das aufgrund seiner homologen Struktur mit Plasminogen eine prothrombotische und proinflammatorische Wirkung besitzt. Diese Eigenschaften verleihen Lp(a) im Vergleich zu anderen Lipoproteinen eine fünf- bis sechsmal höhere Atherogenität.
Die Konzentration von Lp(a) wird zu etwa 90 % genetisch determiniert und erreicht bereits ab dem fünften Lebensjahr stabile Werte. Einige nicht-genetische Faktoren wie chronische Erkrankungen oder hormonelle Dysbalancen können jedoch auch im Erwachsenenalter zu einer weiteren Erhöhung führen. Der Lp(a)-Wert sollte daher als zusätzlicher Risikofaktor zumindest einmal im Leben – bei Frauen zusätzlich ein weiteres Mal postmenopausal – bestimmt werden.
In der aktualisierten Leitlinie zur Behandlung von Dyslipidämien wurde der Schwellenwert für erhöhte Lp(a)-Spiegel im Serum auf 50 mg/dl (zuvor 30 mg/dl) angehoben. Dieser Wert wird bei rund 20 % der Bevölkerung erreicht und sollte als Risikomodifikator in die individuelle kardiovaskuläre Risikoermittlung einfließen
Lp(a) als Target der Arzneimittelentwicklung
Aufgrund der signifikanten Assoziation zwischen erhöhten Lp(a)-Konzentrationen und dem Auftreten kardiovaskulärer Ereignisse steht Lp(a) seit einigen Jahren im Fokus der pharmazeutischen Forschung. Diese Entwicklung wird zusätzlich dadurch begünstigt, dass bereits zugelassene lipidsenkende Arzneistoffgruppen keine (Statine) bzw. lediglich moderate Effekte (Reduktion um bis zu -20 % unter PCSK9-Inhibitoren) auf den Lp(a)-Spiegel zeigen.
Aktuell befinden sich mehrere RNA-basierte Therapieansätze (z. B.: Antisense-Oligonukleotide und siRNA) in der klinischen Entwicklung, die eine spezifische Reduktion des Lp(a)-Spiegels um über 80 % ermöglichen. Die Ergebnisse einer großen kardiovaskulären Endpunktstudie werden im Laufe des kommenden Jahres erwartet. Ein Therapieansatz aus der orthomolekularen Medizin stellt die Einnahme von Vitamin B3 als Nicotinsäure dar. In Studien konnte nach langsamer Aufdosierung zur Reduktion der Nebenwirkungen (Flush) eine Lp(a)-Senkung von bis zu 22,9 % gezeigt werden. Allerdings steht in Österreich aktuell kein Präparat mit hochdosierter Nicotinsäure zur Verfügung.
Asymmetrisches Dimethylarginin vs. L-Arginin
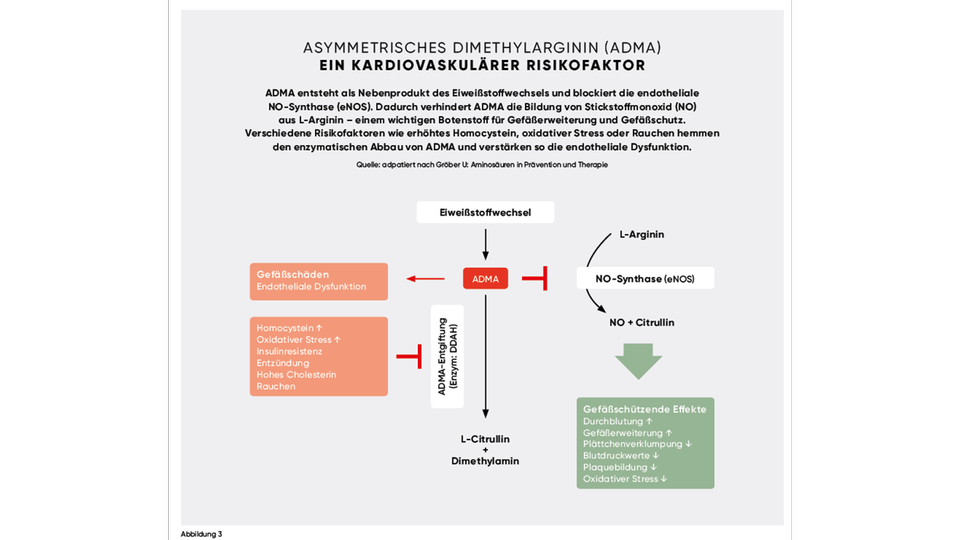
Asymmetrisches Dimethylarginin (ADMA) entsteht im Rahmen der posttranslationalen Modifikation durch Protein-Methyl-Transferasen (PRMT) der Aminosäure L-Arginin. Die Ausscheidung dieser methylierten Argininderivate erfolgt nach Abbau durch Dimethylarginin-dimethylaminohydrolasen (DDAH) über die Niere. Erhöhte Plasmaspiegel von ADMA (> 0,7 μmol/l) kennzeichnen eine endotheliale Dysfunktion und stehen in Zusammenhang mit kardiovaskulären Erkrankungen wie Hypertonie, koronarer Herzkrankheit und Diabetes. Dieser Effekt basiert auf dem Antagonismus von ADMA mit L-Arginin, das als Substrat der endothelialen NO-Synthase (eNOS) die Bildung von Stickstoffmonoxid (NO) fördert. Bei einer Verschiebung des Gleichgewichts zwischen ADMA und L-Arginin (ADMA-Arginin-Ratio Sollwert: 1:50 bis 1:100) zugunsten von ADMA kommt es zur Senkung des Stickstoffmonoxid-Spiegels (NO) und folglich durch die ausbleibende Vasodilatation der glatten Gefäßmuskulatur im Endothel zur Blutdruckerhöhung. Die Gründe für erhöhte ADMA-Spiegel sind noch nicht genau geklärt. Vermutet wird neben erhöhtem Homocystein und nitrosativem sowie oxidativem Stress auch eine Dysfunktion des Abbauprozesses über DDAH (siehe Abbildung 3). Eine Möglichkeit zur Unterstützung der endogenen NO-Synthese durch Verdrängung von ADMA bietet die Substitution von L-Arginin in Kombination mit L-Citrullin im Verhältnis 2 : 1 zur besseren Bioverfügbarkeit und Wirkungsverstärkung von L-Arginin.
Die Rolle von Homocystein
Homocystein ist eine nicht-proteinogene, schwefelhaltige Aminosäure, die im Körper als Abbauprodukt der Aminosäure L-Methionin bei der Übertragung von Methylgruppen entsteht und zelltoxische Eigenschaften durch beispielsweise DNA-Schädigung und Proteinmodifikationen besitzt. Die enzymatische Entgiftung von Homocystein erfolgt unter Anwesenheit der Co-Faktoren Folsäure, Vitamin B2, B6 und B12 über
die Remethylierung zu L-Methionin (Methionin-Synthase) oder die Umwandlung in L-Cystein. Bei reduzierter Enzymaktivität durch Nährstoffmängel kommt es vorerst intrazellulär und nach Ausschleusung aus der Zelle aufgrund der zelltoxischen Wirkung folglich auch extrazellulär zur Konzentrationserhöhung von Homocystein. Eine Hyperhomocysteinämie liegt ab Plasmaspiegeln von > 9 μmol/l vor und zählt als Risikofaktor für kardiovaskuläre, cerebrale und neurodegenerative Erkrankungen wie Herzinfarkt, Schlaganfall, Demenz, Diabetes, Osteoporose und diverse Augenerkrankungen wie Glaukom. Der Homocysteinspiegel wird durch verschiedene Faktoren wie genetische Veranlagung, Lebensstil und diverse Arzneimittel wie Diuretika, orale Kontrazeptiva, Laxanzien, Metformin, Protonenpumpenhemmer etc. beeinflusst, die als Gemeinsamkeit eine Senkung der essenziellen Homocysteinregulatoren haben. Eine Zufuhr dieser Nährstoffe kann den Homocysteinabbau fördern und das Krankheitsrisiko senken.
Quellen
• S3-Leitlinie: Hausärztliche Risikoberatung zur kardiovaskulären Prävention 2024, AWMF Reg. Nr. 053-024
• Mach F, et al.: 2025 Focused Update of the 2019 ESC/EAS Guidelines for the management of dyslipidaemias. Atherosclerosis 2025; 409: 120479
• De Oliveira-Gomes D, et al.: Apolipoprotein B: Bridging the gap between evidence and clinical practice. Circulation 2024; 150(1): 62-79
• Dowsett L, et al.: ADMA: A key player in the relationship between vascular dysfunction and inflammation in atherosclerosis. J Clin Med 2020; 9(9): 3026
• Hermann A, et al.: Homocysteine: Biochemistry, molecular biology and role in disease. Biomolecules 2021; 11(5): 737
Weitere Literatur auf Anfrage




.jpg)