Pharmakokinetische Arzneimittelinteraktionen bei Leberinsuffizienz
Bei progredienter Leberzirrhose sind zwei entscheidende Mechanismen für pharmakokinetische Interaktionen in der Leber vermindert: zum einen die Aufnahme von CYP-Inhibitoren und -Induktoren in die Leber, zum anderen die Expression der CYP 450-Isoenzyme.
Die daraus resultierenden Effekte sind schwer vorhersehbar. Daher sollten Plasmaspiegel und Wirkungen kritischer Arzneistoffe möglichst engmaschig überwacht werden. Bei geringgradiger oder moderater Leberinsuffizienz können potenzielle Arzneimittelinteraktionen sowie CYP-Induktionen und -Inhibitionen ähnlich wie bei Lebergesunden beurteilt werden. Liegt hingegen eine schwere Leberinsuffizienz vor, sind allgemeingültige Vorhersagen nicht möglich.
Pharmakokinetische Einflussfaktoren
Bei Leberinsuffizienz kommt es zu einer Beeinflussung des hepatischen Blutflusses. Da der Zugang von Arzneistoffen zu den Leberenzymen von der Bindung an Albumin und andere Plasmaproteine abhängig ist, spielen sowohl die Enzymaktivität als auch der Gallefluss eine signifikante Rolle. Ein pharmakonspezifischer Parameter von besonderer Relevanz ist der Q₀-Wert: Je niedriger der Q₀-Wert eines Arzneistoffs, desto stärker erfolgt dessen renale Elimination. Liegt der Q₀-Wert bei 1, wird der betreffende Wirkstoff nahezu ausschließlich über die Leber eliminiert.
Weitere arzneistoffspezifische Einflussgrößen sind die hepatische Extraktionsrate sowie die intrinsische Clearance. Für die Geschwindigkeit der hepatischen Metabolisierung ist insbesondere der uneingeschränkte Zugang der Hepatozyten zum Pharmakon entscheidend. Eine ideale Pharmakotherapie berücksichtigt somit die genaue Wirkstoffauswahl, das Dosierschema und den Applikationsweg.

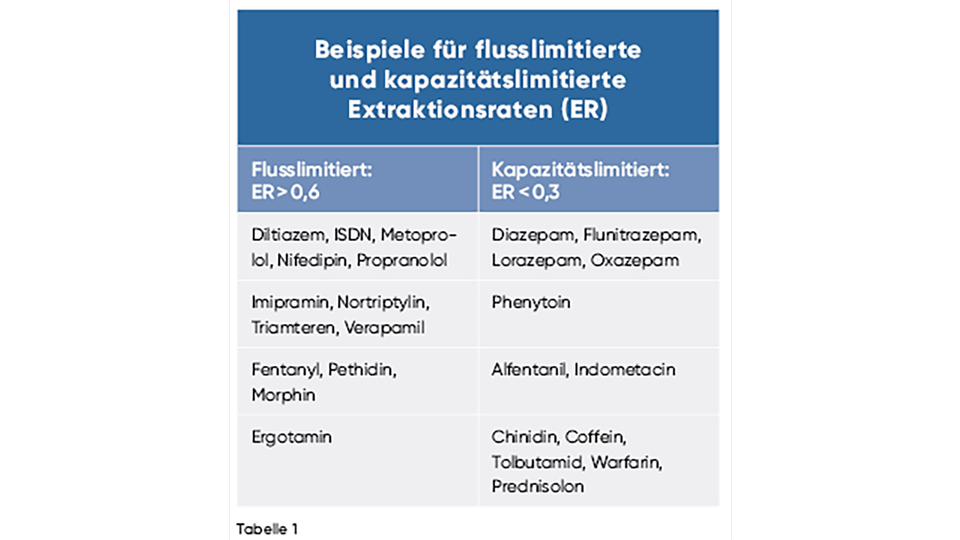
Extraktionsraten bei Leberinsuffizienz
Bei Leberinsuffizienz unterscheidet man zwei Arten von Extraktionsraten:
1) Flusslimitierte Extraktionsrate
Diese tritt auf, wenn der Blutfluss zur Leber eingeschränkt ist. Dadurch gelangt weniger Arzneistoff in die Leber, was die Metabolisierung reduziert.
2) Kapazitätslimitierte Extraktionsrate
Diese entsteht, wenn die Enzymkapazität der Leberzellen für den Arzneistoffmetabolismus nahezu erschöpft ist. Selbst bei ausreichendem Blutfluss kann die Leber den Wirkstoff nicht mehr effektiv abbauen, da die Enzyme nicht mehr voll funktions- und leistungsfähig sind.
Sind sowohl der hepatische Blutfluss als auch die enzymatische Kapazität beeinträchtigt, kann die Extraktionsrate erheblich reduziert sein. Dies führt häufig zu einer erhöhten Bioverfügbarkeit des Medikaments, was wiederum verstärkte Wirkungen und potenzielle Toxizitäten zur Folge haben kann.
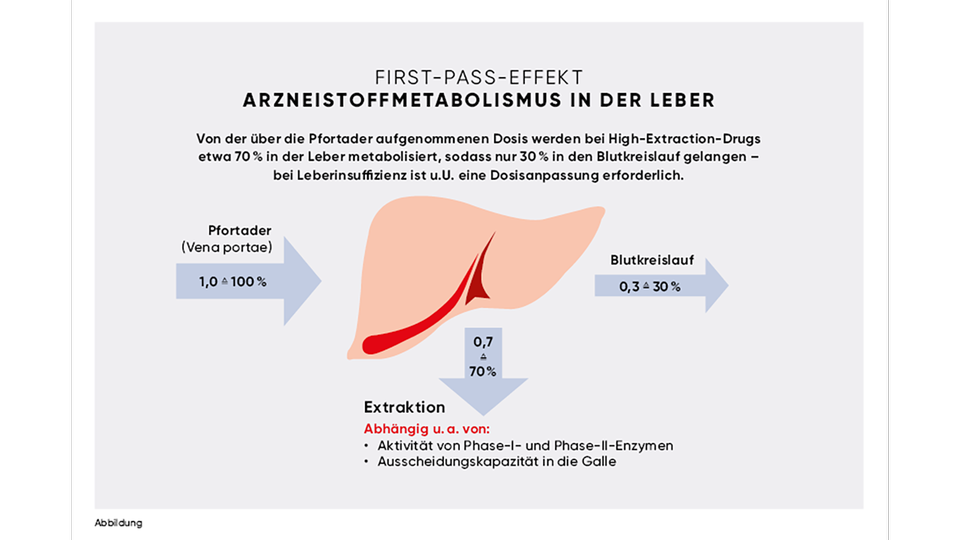
Was sind High-, Low- und Intermediate-Extraction-Drugs?
Diese Begriffe beschreiben Arzneistoffe, die unterschiedlich stark vom hepatischen Metabolismus während der ersten Leberpassage betroffen sind:
• High-Extraction Drugs
(> 60–70 % Metabolismus bei erster Passage)
Sie weisen eine niedrige orale Bioverfügbarkeit auf, da ihr Metabolismus stark vom hepatischen Blutfluss abhängt.
• Low-Extraction-Drugs
(< 30–40 % Metabolismus)
Sie zeigen eine höhere Bioverfügbarkeit, da die CYP-basierten Metabolisierungswege weniger effektiv sind. Bei gleichbleibender Dosis ist in der Regel eine Anpassung erforderlich.
• Intermediate-Extraction-Drugs
(30–70 % Metabolismus)
Diese unterliegen einer mäßigen hepatischen Metabolisierung; die Dosierung sollte individuell an die klinische Situation angepasst werden.
Bei älteren Arzneistoffen sind die genauen hepatischen Abbauwege häufig nicht vollständig bekannt.
Zusätzlich können Faktoren wie der Albuminspiegel und die hepatische Durchblutung die Metabolisierung maßgeblich beeinflussen. Eine regelmäßige Kontrolle der Leberwerte ist essenziell. Leichte Erhöhungen der Transaminasen sind in der Regel unbedenklich.
Bei Vorliegen einer Cholestase sollte der Einsatz potenziell cholestatischer Medikamente kritisch hinterfragt werden, da diese eine bestehende Hepatitis verschlimmern können.
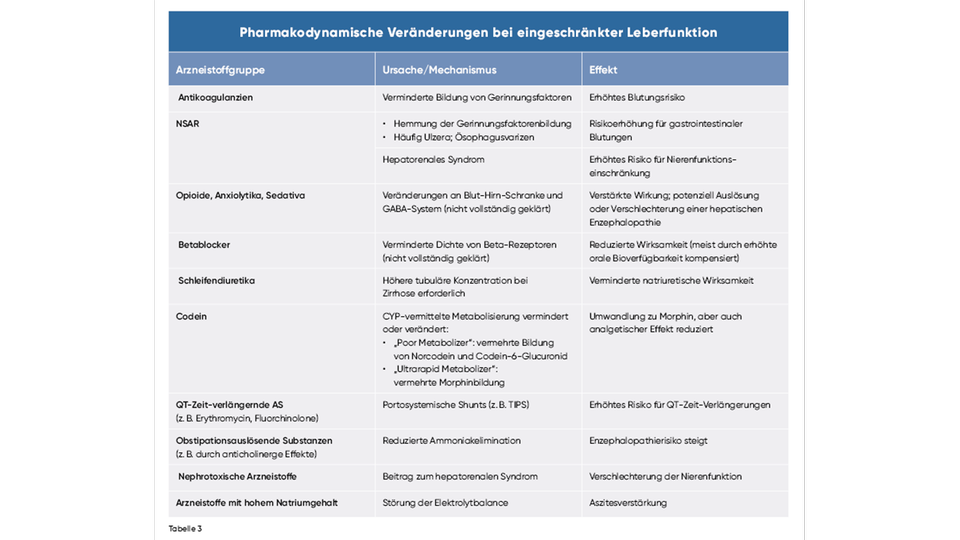
Bei Leberinsuffizienz können sowohl Wirkungsveränderungen als auch das Risiko für Nebenwirkungen zunehmen – beispielsweise ein erhöhtes gastrointestinales Blutungsrisiko bei der Anwendung von Kortikosteroiden, Bisphosphonaten oder SSRI. Trotz potenzieller Hepatotoxizität sind viele Medikamente bei eingeschränkter Leberfunktion nicht grundsätzlich kontraindiziert, sollten jedoch unter sorgfältiger klinischer Überwachung eingesetzt werden.
Veränderungen der Arzneistoff-Bioverfügbarkeit bei Leberinsuffizienz
Bei Leberinsuffizienz verändert sich die Bioverfügbarkeit von Arzneistoffen (AS) maßgeblich. Bei Aszites und Ödemen kommt es zu einer Erhöhung des Extrazellullarraumvolumens, was zu einem veränderten Verteilungsvolumen führt. Eine verminderte Plasmaalbuminbindung erhöht die Konzentration des freien, pharmakologisch aktiven Arzneistoffs. Dennoch bleibt die klinische Relevanz der verminderten Albuminproduktion für die veränderte Arzneimittelwirksamkeit schwer abschätzbar.
Weitere Bioverfügbarkeitsbetrachtungen bei Leberinsuffizienz
Malabsorption
Eine verminderte Gallensäuresekretion reduziert die Fettresorption sowie die Aufnahme großer Moleküle, was die Bioverfügbarkeit bestimmter Medikamente beeinflussen kann. Besonders bei Arzneistoffen mit enger therapeutischer Breite und hepatotoxischem Potenzial kann dies das Risiko für Leberschäden oder eine Verschlechterung der Leberinsuffizienz erhöhen.
Hepatische Enzephalopathie
Bestimmte Medikamente wie Opioide (z. B. Morphin, Pethidin) und Diuretika (z. B. Furosemid, Hydrochlorothiazid) können neurotoxische Effekte verstärken.
Aszites
Pharmaka, die eine Flüssigkeitsretention fördern – etwa NSAR, Hydralazin oder Glukokortikoide – können bestehende Aszites und Ödeme aggravieren.
Cholestase
Viele Arzneistoffe, z. B. Thiamazol, Erythromycin, Chlorpromazin, Ciclosporin, Carbamazepin, Tamoxifen, Busulfan, Verapamil und Nifedipin, können reversible Cholestasen auslösen.
Virushepatitiden
Zu Beginn ist die Leberfunktion oft nicht eingeschränkt, gelegentlich sogar gesteigert. Dennoch sollten lebermetabolisierte Medikamente möglichst vermieden werden.
Therapieprinzipien bei Lebererkrankungen
Bei Lebererkrankungen ist eine Dosisreduktion insbesondere bei hepatisch hoch extrahierenden Pharmaka sinnvoll.
Eine exakte Dosisanpassung ohne spezielle Tests ist jedoch schwierig. Daher empfiehlt sich ein therapeutisches Drugmonitoring (TDM). Das Prinzip „Start low, go slow“ gilt: Mit niedriger Dosis beginnen, schrittweise steigern und die Patient:innen engmaschig beobachten. Bei Medikamenten mit klaren Kontraindikationen wären Alternativen mit renaler Elimination eine Option – diese sind jedoch häufig nicht verfügbar.
Das EAHP Statement 5.6
Der direkte Kontakt zum Arbeitskreis
Krankenhauspharmazie der ÖAZ per E-Mail:
arbeitskreis.oeaz@krankenhausapotheke.at. Wir freuen
uns über Rückmeldungen und Themenvorschläge.
QUELLEN
Literatur liegt beim Autor
_GESPAG_SW.jpg)